La resistencia a la insulina es la llave para el desarrollo de muchas de las enfermedades crónicas modernas.
A principios del siglo XX, las enfermedades infecciosas eran la principal causa de mortalidad, con la neumonía a la cabeza.
En este siglo XXI, son las enfermedades cardiovasculares las que lideran el podio, seguidas del cáncer y las complicaciones derivadas de la diabetes.
Los grandes avances en el campo de la genética nos han llevado a descubrir que muchas de las enfermedades modernas no dependen de uno o varios genes, sino que éstos solo crean una predisposición hacia ciertas patologías.
Será el estilo de vida el responsable en última instancia de que desarrollemos cierta enfermedad creando la alteración metabólica necesaria.
Según el estudio del Dr. Kraft de 2008, «Diabetes Epidemic and You», la resistencia a la insulina es la alteración metabólica más frecuente hoy día y, sin embargo, la menos diagnosticada.
A partir de los 40 años, 4 de cada 5 personas presentan ya cierto grado de resistencia a la insulina.
Veamos qué es la resistencia a la insulina, sus causas, sus consecuencias y otros aspectos de esta enfermedad tan relevante hoy día.
Contenido
- 1 Qué es la insulina
- 2 Qué es la resistencia a la insulina
- 3 Causas de la resistencia a la insulina
- 4 Síntomas de la resistencia a la insulina
- 5 Consecuencias de la resistencia a la insulina
- 5.1 Resistencia a la insulina y diabetes tipo II
- 5.2 Síndrome metabólico
- 5.3 Resistencia a la insulina y obesidad
- 5.4 Resistencia a la insulina, hipertensión y ateroesclerosis
- 5.5 Resistencia a la insulina y Alzheimer
- 5.6 Resistencia a la insulina y cáncer
- 5.7 Resistencia a la insulina y ovario poliquístico
- 5.8 Resistencia a la insulina e hígado graso no alcohólico
- 6 Diagnóstico de la resistencia a la insulina
- 7 Tratamiento de la resistencia a la insulina
- 8 Resistencia a la insulina y el genotipo ahorrador (thrifty)
Qué es la insulina
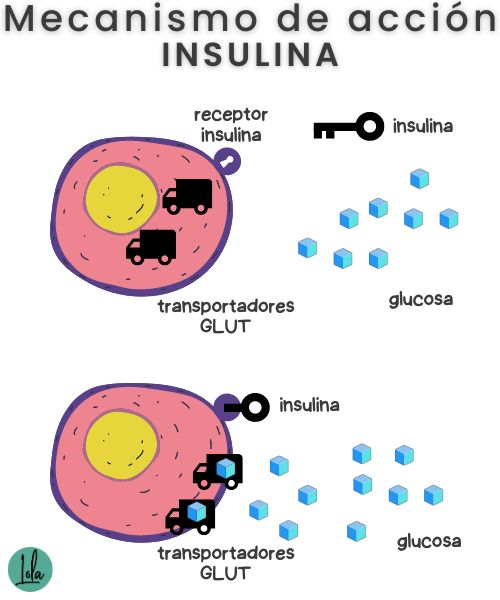
La insulina es una hormona segregada por las células beta del páncreas en respuesta a diversos estímulos, principalmente la glucosa, y cuyo papel más destacado consiste en permitir la entrada de glucosa en las células de sus tejidos diana: el músculo, el tejido adiposo y el hígado.
La insulina afecta de manera directa o indirecta a todos los tejidos del organismo.
Su función última sería mantener la homeostasis glucémica, es decir, los niveles de glucosa en sangre dentro de unos parámetros tanto en los estados de ayuno como cuando comemos.
La insulina se une a unos receptores situados en la superficie de las células y provoca la activación de las proteínas encargadas de transportar la glucosa al interior (GLUT).
Estas proteínas transportadoras son distintas dependiendo del tejido en el que se encuentren. Por ejemplo, en el músculo y el tejido adiposo se encuentra la GLUT-4, que transporta glucosa al interior cuando está presente la insulina.
Las células cerebrales contienen GLUT-1, que no necesita insulina para absorber glucosa, lo que garantiza su funcionamiento incluso en ayuno.
Además de la glucosa y otros azúcares, otros factores afectan a la liberación de insulina, como ciertas hormonas, algunos aminoácidos, el estrés e incluso estímulos cerebrales.
En el músculo, la insulina favorece la captación de glucosa, su uso como combustible y su almacenamiento en forma de glucógeno. Además, estimula la formación de proteínas en presencia de aminoácidos.
El músculo esquelético es el responsable de aproximadamente el 80% de la utilización de la glucosa post-pandrial, por lo que es considerado el mayor contribuidor a la resistencia a la insulina.
En el hígado, la insulina activa la síntesis de glucógeno y disminuye la gluconeogénesis.
En el tejido adiposo blanco suprime la lipólisis (quema de grasa) y aumenta la lipogénesis (síntesis de grasa). Esto se traduce en que disminuye la liberación de ácidos grasos y favorece la síntesis de triglicéridos.
En general, se considera a la insulina como una hormona anabólica, o más bien anti-catabólica, cuya función última sería evitar la pérdida de nuestras reservas energéticas.
Además de sus efectos a nivel del metabolismo energético, la insulina es también una hormona vascular, clave para activar la enzima responsable de producir óxido nítrico (NO) en el endotelio de los vasos. El NO relaja la musculatura vascular.
Sin embargo, en cuadros de resistencia a la insulina, ésta actuaría como vasoconstrictor.
A nivel del sistema nervioso central, la insulina tiene un papel neuromodulador, participando en numerosos procesos cognitivos, las conductas de la alimentación y el metabolismo de la glucosa cerebral.
Qué es la resistencia a la insulina
La resistencia a la insulina se produce cuando las células diana de esta hormona, es decir, las células de los músculos, la grasa y el hígado, no responden bien a la insulina y no pueden absorber la glucosa circulante en la sangre.
Para intentar mantener los niveles de glucemia en su rango normal se produce una liberación extra de insulina, lo que genera una hiperinsulinemia compensatoria.
Mientras el páncreas pueda producir suficiente insulina para superar la débil respuesta de las células, la glucemia se mantendrá en un rango saludable. Estamos ante un estado pre-diabético.
Con el tiempo, las células del páncreas se agotan y ya no son capaces de mantener la hipersecreción de insulina y aparece la diabetes tipo II con aumento de la glucemia por un lado y los ácidos grasos libres por otro, con una importante glucolipotoxicidad.
El binomio resistencia a la insulina/hiperinsulinemia se asocia a un aumento significativo de la mortalidad cardiovascular por ateroesclerosis, ictus y otras patologías que en conjunto se ha denominado síndrome metabólico.
En importante diferenciar ambos conceptos. El síndrome metabólico es un concepto clínico, mientras que la resistencia a la insulina es una alteración a nivel celular que disminuye la actividad de la insulina en sus distintos órganos diana.
Causas de la resistencia a la insulina
La disminución a la sensibilidad a la insulina aparece en situaciones fisiológicas como cuando existe trauma o infecciones. En estos casos, la resistencia a la insulina generaría una disminución del almacenamiento de la glucosa en el músculo esquelético, favoreciendo su uso por otros tejidos no insulino-dependientes como los eritrocitos o el cerebro.
En la pubertad, por ejemplo, la resistencia a la insulina reflejaría una adaptación al crecimiento acelerado.
Y lo mismo sucedería durante la gestación, en el que aseguraría por un lado el crecimiento del feto y por otro evitaría los estados de hipoglucemia en la madre en períodos de ayuno prolongado.
En estas condiciones, la resistencia a la insulina tiene un origen concreto y es, en la mayoría de los casos, reversible.
Sin embargo, existen otros casos en los que las causas no están claras y son objeto de una gran investigación.
En principio, se reconoce un componente genético, por un lado, y causas adquiridas, por otro, donde la resistencia a la insulina sería consecuencia del estilo de vida.
Se han desarrollado múltiples teorías para explicar la aparición de la resistencia a la insulina, aunque lo cierto es que a día de hoy no existe consenso científico.
Probablemente, y más allá de la predisposición genética, exista una confluencia de razones que conduzcan al desarrollo de la enfermedad.
Factores predisponentes
- Edad (mayor 30 años)
- Sexo femenino
- Multiparidad (haber tenido varias gestaciones)
- Antecedentes familiares de diabetes gestacional
- Bajo peso al nacer
- Antecedentes familiares de diabetes tipo 2
- Alcoholismo
- Tabaquismo
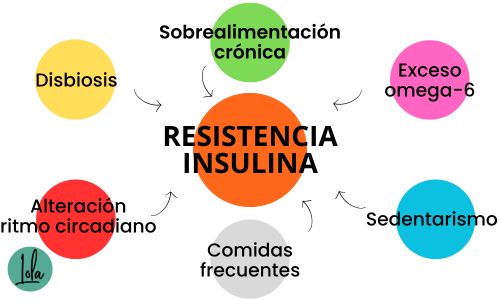
Sobrealimentación crónica
Un exceso de calorías sostenido en el tiempo, es decir, consumir más calorías de las que gastamos lleva a la resistencia a la insulina, además de aumentar los acúmulos de tejido adiposo que agravarán el problema.
En el caso de exceso de ingesta de carbohidratos, a través de la lipogénesis de novo se convierten en lípidos para su almacenamiento. Esta lipogénesis de novo llevada a cabo especialmente en hígado y adipocitos conducirá a un aumento de la resistencia a la insulina por el acúmulo de grasa en hígado y músculo.
Cuando el exceso de energía consumida es a partir de una dieta rica en grasas, la conversión de carbohidratos en ácidos grasos es menor por inhibición de la lipogénesis en el tejido adiposo.
Exceso de ácidos grasos poliinsaturados Omega 6
Especialmente por el consumo excesivo de ácido linoleico derivado de los aceites de semillas refinados como el de girasol, canola o soja.
Sedentarismo
La falta de ejercicio físico conduciría a una disminución de la biogénesis de mitocondrias y una disminución de la absorción de glucosa por parte del músculo esquelético.
Estrés
Tanto la activación del eje hipotálamo-glándula adrenal, que activa las hormonas contra-reguladoras como el cortisol, como por efecto del estado inflamatorio generado, el estrés crónico es una causa de resistencia a la insulina muchas veces infravalorada.
Comidas demasiado frecuentes
El acceso constante a alimentos disminuye el tiempo entre ingestas, no permitiendo que las hormonas implicadas en el control de la glucemia alcancen sus niveles base (insulina, glucagón y leptina, principalmente), disminuyendo los procesos de reparación celular.
Falta de descanso nocturno
Existe cada vez más evidencia de que la falta de sueño crónica está relacionada con la resistencia a la insulina a través de varios mecanismos como la activación del eje hipotálamo-hipofisiario, por un lado, y la disminución de la hormona leptina.
Alteración del ritmo circadiano
La falta de exposición a la luz solar combinada con un exceso de luz azul de los dispositivos electrónicos altera los biorritmos hormonales naturales, especialmente del cortisol y la hormona del crecimiento.
Disbiosis o alteración de la microbiota
Numerosos estudios muestran el papel del equilibrio de la microbiota en el desarrollo de la resistencia a la insulina por reducción de la diversidad bacteriana, disminución de las bacterias productoras de butirato o menor proporción de bacterias gram-positivas, entre otros.
Síntomas de la resistencia a la insulina
A menudo, la resistencia a la insulina no causa síntomas evidentes.
Algunas personas pueden experimentar síntomas indeterminados:
- Cansancio o debilidad
- Hambre excesiva o muchos antojos
- Sed aumentada con aumento del número de micciones (poliuria/polidipsia)
- Visión borrosa
- Infecciones recurrentes
El gran problema de la resistencia a la insulina es que está poco reconocida por la mayoría de los clínicos y no se tiene en consideración más allá de la diabetes tipo 2.
En la mayoría de las consultas de atención primaria no se realizan test de insulina.

Sin embargo, otros parámetros analíticos pueden ser indicativos de resistencia a la insulina:
- Colesterol-HDL <35 en hombres y <45 mg/dL en mujeres
- Índice cintura-cadera > 0,90 en hombres y >0,85 en mujeres
- Hipertensión >140/90 mm Hg
- Triglicéridos ≥200 mg/dL
- Glucemia en ayunas ≥100 mg/dL
Si quieres comprobar tu índice cintura-cadera, tenemos un artículo donde explicamos cómo.
Consecuencias de la resistencia a la insulina
Resistencia a la insulina y diabetes tipo II
La consecuencia más destacable de la resistencia a la insulina es la diabetes tipo II.
En este tipo de diabetes, el organismo es capaz de producir insulina, pero debido a la resistencia celular a esta hormona la glucosa circulante no puede ser absorbida y aumenta la glucemia.
Cuando aumentan los niveles de glucosa en sangre al verse dificultada su absorción celular se genera una elevación compensatoria de la producción de insulina, que, como hormona anabólica que es, contribuirá a un aumento aún mayor de peso, que a su vez exacerba la resistencia a la insulina.
Este círculo vicioso continua hasta que las células beta del páncreas ya no son capaces de compensar las necesidades aumentadas de insulina y se genera diabetes tipo II.
El 80-90% de los diabéticos son de tipo 2 o no insulino-dependientes, es decir, su páncreas produce insulina, pero no es suficiente para controlar la glucemia y se crea una hiperglucemia crónica.
La diabetes tipo II es prácticamente asintomática en sus estadíos iniciales y se calcula que hasta el 50% de personas con esta enfermedad conviven con ella durante años, agravando el pronóstico.
Cualquier persona de más de 40 años con antecedentes familiares de diabetes debería ser testeado.
Síndrome metabólico
Se le llamó inicialmente síndrome de la resistencia insulínica o síndrome X.
El síndrome metabólico sería el conjunto de alteraciones que aumentan el riesgo de enfermedad cardiovascular y diabetes.
Estas alteraciones incluyen resistencia a la insulina, obesidad abdominal, dislipidemia, hipertensión arterial e inflamación crónica.
Los distintos organismos internacionales han propuesto varias definiciones, pero en general se ha acordado la importancia del índice cintura-cadera como valor predictor del síndrome metabólico.

Resistencia a la insulina y obesidad
Desde hace algo más de una década se sabe que el tejido adiposo visceral tiene características metabólicas distintas al de la grasa subcutánea, siendo considerado hoy día un órgano endocrino que libera ácidos grasos al torrente sanguíneo, por un lado, y una serie de proteínas llamadas adipocitoquinas, por otro, que controlan varias funciones metabólicas y algunas de las cuales poseen actividad proinflamatoria, como TNFalfa, IL-6, resistina, leptina, adiponectina, PAI-I y angiotensinógeno.
En una primera etapa, el paciente obeso presenta resistencia a la insulina exclusivamente en el tejido adiposo, pero en una segunda etapa los ácidos grasos liberados generan lipotoxicidad en el músculo y el hígado, lo que altera el metabolismo de la glucosa en estos tejidos y produce hiperinsulinemia compensatoria.
El agotamiento de las células beta del páncreas unido a la lipotoxicidad existente conducirá a su muerte por apoptosis de estas células.
La elevación crónica de los niveles plasmáticos de glucosa e insulina combinada con las adipoquinas pro-inflamatorias genera una serie de efectos adversos a nivel cardiovascular, aumentando el riesgo de enfermedad coronaria, enfermedad cerebrovascular y otras complicaciones.
No está muy clara si la obesidad es resultado de una resistencia a la insulina incipiente, o bien es una causa, pues también existen individuos con normopeso pero con marcadores de resistencia a la insulina, que se ha venido a llamar «delgados metabólicamente obesos».
Resistencia a la insulina, hipertensión y ateroesclerosis
No está muy claro el mecanismo por el cual la resistencia a la insulina tiene un efecto negativo sobre el endotelio vascular.
Las células endoteliales no solo tienen un papel físico en la circulación sanguínea constituyendo la pared interna de venas y arterias, sino que además secretan una serie de sustancias que influencian el tono de los vasos, la función plaquetaria y la coagulación. Cuando estos procesos están afectados, aparecen manifestaciones clínicas.
El óxido nitroso (NO), fundamental en el funcionamiento de los vasos sanguíneos, es sintetizado a partir del aminoácido L-arginina por las células endoteliales, siendo este proceso favorecido por la insulina.
Cuando aparece la resistencia a la insulina, se produce una disminución de la producción de NO.
Además, la hiperinsulinemia que acompaña a la resistencia a la insulina se asocia con un aumento de factores pro-coagulantes y de la secreción de endotelina 1, un potente vasoconstrictor.
La consecuencia de todo ello sería el aumento de la presión sanguínea.
El aumento del flujo de ácidos grasos libres desde el tejido adiposo al torrente sanguíneo consecuencia de la alteración insulínica aumenta la liberación de triglicéridos y colesterol VLDL por parte del hígado, a la par que disminuyen los niveles de colesterol bueno o HDL. Esta triada tiene un gran poder aterogénico.
Resistencia a la insulina y Alzheimer
Recientemente se ha dado por llamar a la enfermedad de Alzheimer la diabetes tipo 3 por su estrecha relación con el metabolismo de la glucosa.
Una hemoglobina glicosilada elevada es un factor de riesgo para la progresión de la atrofia cerebral entre las personas mayores.
El cerebro no depende de la insulina para absorber glucosa, pero está relacionada con el control del apetito y la saciedad, el olfato, la memoria y el funcionamiento cognitivo.
Se está estudiando la relación entre la enfermedad de Alzheimer y la resistencia a la insulina, dada la función de esta hormona en la regulación de la proteína precursora de amiloide.
Resistencia a la insulina y cáncer
Aunque los mecanismos todavía no están claros, se ha visto una relación entre la hiperinsulinemia y ciertos tipos de cánceres.
Las células cancerosas tienen menos mitocondrias y además menos funcionales, lo que las obliga a obtener energía a partir de la fermentación aeróbica, lo que se ha denominado efecto Warburg, según el cual las células tumorales dependen del aporte de glucosa para su supervivencia.
La resistencia a la insulina permite un aporte continuo de glucosa a las células tumorales, favoreciendo su crecimiento.
Pero además la hiperinsulinemia tiene un efecto carcinogénico al estimular el IGF-1.
Se relaciona la resistencia a la insulina con cáncer de colon, endometrio y mama, especialmente.
Resistencia a la insulina y ovario poliquístico
Este síndrome tiene un origen oscuro, aunque se sospecha que la resistencia a la insulina juega un importante papel.
Se considera al PCOS una patología multifactorial con componente genético, metabólico, endocrino y medioambiental.
La insulina tiene la capacidad de estimular la síntesis ovárica de andrógenos.
En casos de hiperinsulinemia se produce una sobreproducción de andrógenos a nivel ovárico a través de la IGF-1, y al mismo tiempo se produce una producción limitada de estrógenos.
Con la obesidad se inicia la aromatización de los andrógenos, agravando el problema.
Todo ello conduce a un estado de hiperandrogenismo y anovulación crónica.
Resistencia a la insulina e hígado graso no alcohólico
El hígado graso no alcohólico está siendo cada vez más reconocido, viendo prevalencias de hasta 10-24% de la población general, y subiendo hasta el 50 a 75% de las personas obesas.
En esta condición existe un riesgo de evolución a esteatohepatosis, esteatohepatitis, fibrosis y hasta cirrosis.
El aumento en la liberación de ácidos grasos derivada de la resistencia a la insulina aumenta la producción de triglicéridos en el hígado, con el consiguiente acúmulo.
Diagnóstico de la resistencia a la insulina
Clínicamente se reconoce la resistencia a la insulina a partir de sus consecuencias metabólicas.
Existen varias pruebas de laboratorio para el diagnóstico de la resistencia a la insulina como el clamp euglicémico-hiperinsulinémico, el índice HOMA-IR, test de la tolerancia oral a la glucosa…
Todos estos métodos se utilizan con fines de investigación.
Sin embargo, a nivel clínico, el diagnóstico de la resistencia a la insulina debe basarse en una serie de criterios independientes, ya que los resultados de los test de laboratorio son de difícil interpretación individual.
Se sospechará de resistencia a la insulina:
- Obesidad abdominal
- Hiperglucemia
- Hipertrigliceridemia
- Colesterol HDL bajo
La presencia de varios de estos criterios y sus valores determinan el diagnóstico, pero existen variaciones entre los distintos organismos internacionales.
Si se sospecha de pre-diabetes, se utilizan una serie de pruebas analíticas:
- Prueba HbA1C: 5,7 a 6,4%
- Glucemia en ayunas: 100 a 125 mg/dl
- Prueba oral de tolerancia a la glucosa: 140 a 199 mg/dl
La prueba de la hemoglobina glicosilada (HbA1c) mide el promedio de glucosa en sangre durante los últimos 3 meses.
Tratamiento de la resistencia a la insulina
A excepción de los casos de resistencia a la insulina fisiológicos, siempre debe instaurarse tratamiento para corregir este problema. Y entre esas medidas, destacan las de tipo no farmacológico.
Cambios en el estilo de vida son claves en el tratamiento de la resistencia a la insulina y suponen la forma más efectiva de prevenir el desarrollo de diabetes tipo II.
Estilo de vida
Las personas en riesgo deberían iniciar un programa de actividad física combinado con cierta restricción calórica, sueño y un buen control del estrés.
- Dieta para la resistencia a la insulina
Las dietas bajas en carbohidratos parecen ser las de elección a la hora de mejorar la sensibilidad a la insulina.
En el paciente obeso, la primera medida a tomar será la reducción de peso con una restricción calórica moderada.
Como recomendaciones generales, se evitarán los carbohidratos simples y los aceites de semillas refinados (canola, girasol…).
Un componente importante de la dieta orientada a la disminución de la resistencia a la insulina es el almidón resistente, capaz de alcanzar el colon y ser metabolizado por distintas bacterias para producir ácidos grasos de cadena corta.
Se ha visto una relación inversa entre estos ácidos grasos de cadena corta y la resistencia a la insulina.
- Ejercicio físico y resistencia a la insulina
El ejercicio físico per se disminuye la resistencia a la insulina. Además, en el paciente obeso facilita la pérdida de peso.
La actividad física promueve adaptaciones en la fibra muscular: mayor vascularización, aumento de los transportadores de glucosa GLUT-4, aumento de la densidad mitocondrial y aumento del tamaño de los depósitos de glucógeno. Todo ello favorece una mejora de la sensibilidad a la insulina.
La práctica del ejercicio se iniciará de manera suave y se irá aumentando la intensidad de manera gradual. Además, en individuos de más de 40 años se recomienda una valoración cardiovascular previa.
Tratamiento farmacológico
Existen en el mercado varios medicamentos insulino-sensibilizantes, que deben usarse siempre bajo prescripción médica.
- Metformina
Es el fármaco de elección en el tratamiento de diabetes tipo II y PCOS. Se indica combinada con dieta y ejercicio en pacientes con hiperglucemia resistente, y funciona disminuyendo la producción de glucosa por parte del hígado y su absorción a nivel intestinal. Tiene una serie de riesgos a nivel renal.
- Semaglutida (Ozempic®, Wegovy® ) y Liraglutida (Saxenda®)
Estos fármacos han saltado a la palestra recientemente por su uso para perder peso que se ha hecho viral en las redes sociales a través de personajes públicos como Kim Kardashian y Elon Musk, llegando a generar problemas de abastecimiento.
Son agonistas, es decir, análogos, de la hormona GLP-1, una incretina sintetizada en el intestino y que aumenta la secreción de insulina, suprime la de glucagón y enlentece el vaciado gástrico y la gluconeogénesis hepática.
La semaglutida es de desarrollo posterior a la liraglutida, y se ha conseguido aumentar la vida media, pasando de la inyección diaria de la liraglutida a la inyección semanal de la semaglutida.
Los efectos secundarios van desde náuseas y vómitos hasta diarrea o estreñimiento, pero además podrían aumentar el riesgo de pancreatitis y desarrollo de ciertos tumores, aunque hacen falta más estudios al respecto.
En casos de diabetes tipo 2, dados los grandes beneficios de estas 2 sustancias tanto a nivel metabólico como cardiovascular así como el bajo riesgo de efectos secundarios, se están convirtiendo en los fármacos de elección, siempre combinados con una dieta adecuada y ejercicio físico.
- Inhibidores del co-transportador 2 de sodio-glucosa (SCLT2)
Actúa aumentando la secreción de glucosa a nivel renal.
- Otros
Tiazolidinedionas, inhibidores de DPP-4.
Resistencia a la insulina y el genotipo ahorrador (thrifty)
Con el boom de los casos de diabetes tipo II y síndrome metabólico en el mundo se ha visto que la incidencia varía mucho entre los distintos grupos étnicos.
La epidemiología de la diabetes muestra que los indígenas méxico-americanos, los aborígenes australianos y los micronesios, entre otros, presentan cifras de incidencia de diabetes tipo 2 mucho más elevadas que el resto.
Sin embargo, en los caucásicos la frecuencia es menor.
Así que… ¿por qué el estilo de vida occidental no afecta por igual?
Una de las teorías propuestas para explicar esta diferencia en la incidencia de la resistencia a la insulina y la diabetes es que existe un proceso evolutivo de los genes del metabolismo.
Los grupos étnicos que todavía viven como cazadores-recolectores presentan un metabolismo tremendamente efectivo, adaptado a una gran variabilidad en la disposición de los alimentos. Existen épocas de gran abundancia que alternan con otras de hambruna, especialmente en las estaciones de sequía. Los individuos con genotipo adaptado a los ciclos abundancia-hambruna, que se ha denominado ahorrador (thrifty en inglés) prevalecieron en esas sociedades por su ventaja evolutiva.
Con la llegada de la revolución industrial, sin embargo, la disponibilidad de alimentos se reguló y dejaron de existir épocas de hambruna. En este contexto, los individuos con el genotipo ahorrador, que les protegía frente a las hambrunas, estaban de repente en desventaja, pues desarrollaban obesidad y sus complicaciones.
La selección natural protegió a aquellos individuos con genes alternos que no tendían a acumular grasa.
Esto ocurrió en Europa en el siglo XVIII.
Ahora está ocurriendo en los países en vías de desarrollo.
Aunque no conocemos en detalle los complejos mecanismos que subyacen detrás de la resistencia a la insulina, es importante considerar los grandes cambios sociales ocurridos en las últimas décadas con respecto de la actividad física, la alimentación, el estrés, el sueño y el descanso.
La globalización ha generado una verdadera epidemia de enfermedades metabólicas. Y la resistencia a la insulina es, en muchos casos, el inicio del problema. Se prevé que su incidencia se va a incrementar dramáticamente en las próximas décadas.
Una alimentación saludable, la práctica de ejercicio de manera regular, un descanso reparador y un adecuado control del nivel de estrés es hoy más importante que nunca.
¿Qué te ha parecido este artículo? ¿Crees que podrías tener resistencia a la insulina?
Déjanos un comentario. Gracias.
Todos los contenidos ofrecidos por Ecommerce SDR, tales como artículos, podcasts y videos, tienen naturaleza meramente informativa y en ningún caso constituyen servicio médico o sanitario de ningún tipo ni sustituyen la consulta con un médico especialista, por lo que no deben ser aplicados sin la aprobación previa y supervisión de un médico o profesional de la salud especializado.





